来源 | 资本市场法律点评
作者 | 叶玉盛、蒋涛 (竞天公诚)
(图片来源于91加盟网)
一、不负好时光——医疗器械公司在香港资本市场迎来“黄金时代”
香港联合证券交易所有限公司(以下简称“联交所”)于2018年4月修订了主板上市规则,新增第18A章《生物科技公司》(以下简称“18A章”),允许未有收入、未有利润的生物科技公司提交上市申请,同时联交所亦于2018年4月发布了有关生物科技公司上市申请的指引信(HKEX-GL92-18)(以下简称“指引信”)[1],对于生物科技公司依据18A章上市作出了进一步的阐释。
生物科技公司在前期需要大量的资金用于研发、临床试验等,因此通常没有相当的利润符合上市的要求,上市之路比较的坎坷。而18A章以及指引信的发布使得有“硬科技”但尚没有盈利的生物科技公司的上市成为可能。从2019年香港资本市场来看,共有19家生物科技公司成功上市,具体如下:
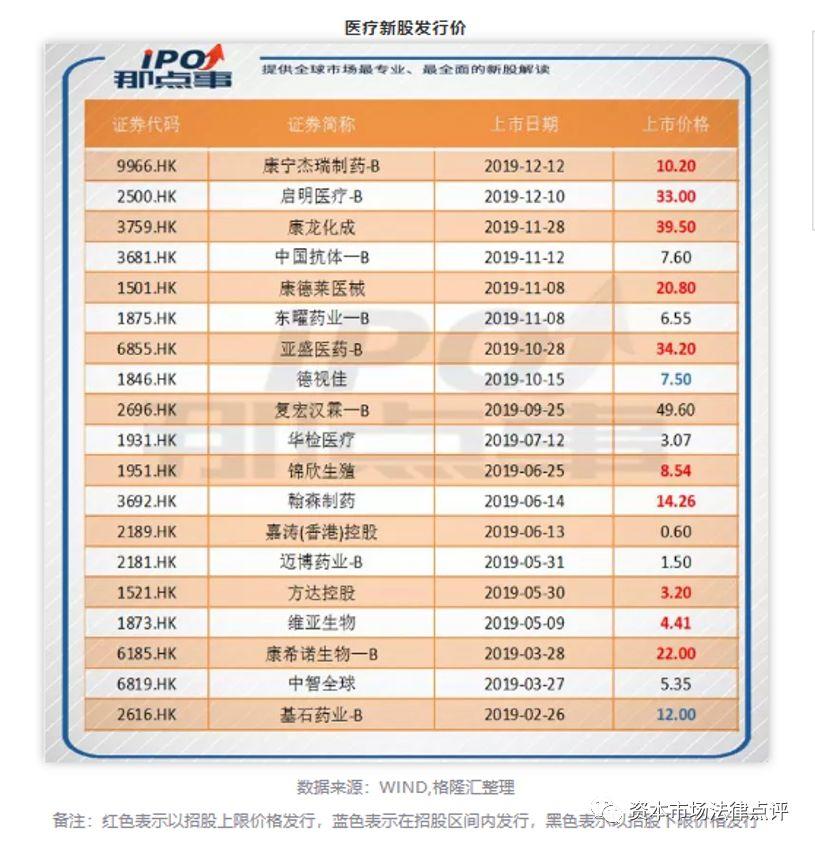
整体来看,这19家生物科技公司中依据18A章上市的共有9家,占比为47.4%。此外,生物科技公司表现良好,其中10家公司以招股上限价格发行股票,2家公司在招股区间内发行股票,只有7家公司以招股下限价格发行股票。生物科技公司中的两家医疗器械公司启明医疗和康德莱医械更是均以招股上限价格发行股票。
截至2020年2月21日收盘时止,上述19家生物科技公司的股价如下:
|
证券代码 |
证券简称 |
股价(港元) |
|
9966.HK |
康宁杰瑞制药-B |
19.420 |
|
2500.HK |
启明医疗-B |
44.800 |
|
3759.HK |
康龙化成 |
56.100 |
|
3681.HK |
中国抗体-B |
3.750 |
|
1501.HK |
康德莱医械 |
39.900 |
|
1875.HK |
东曜药业-B |
3.790 |
|
6855.HK |
亚盛医药-B |
27.800 |
|
1846.HK |
德视佳 |
8.330 |
|
2696.HK |
复宏汉霖-B |
37.500 |
|
1931.HK |
华检医疗 |
3.760 |
|
1951.HK |
锦欣生殖 |
10.460 |
|
3692.HK |
翰森制药 |
26.350 |
|
2189.HK |
嘉涛(香港)控股 |
0.560 |
|
2181.HK |
迈博药业-B |
1.000 |
|
1521.HK |
方达控股 |
5.100 |
|
1873.HK |
维亚生物 |
4.220 |
|
6185.HK |
康希诺生物-B |
81.150 |
|
6819.HK |
中智全球 |
5.800 |
|
2616.HK |
基石药业-B |
10.660 |
生物科技公司上市后的股价表现也整体良好,除了8家公司目前的股价跌破发行价以外,其余的生物医药科技公司目前的股价较发行价格均有不同程度的涨幅。截至2020年2月21日收盘时止,两家医疗器械公司启明医疗和康德莱医械的股价更是分别上涨了35.8%、91.8%。
从以上数据来看,生物科技公司(包括医疗器械公司)在香港资本市场迎来了属于自己的“黄金时代”,我们预测“生物科技”这个赛道在2020年将持续火热。
二、18A章以及指引信对于医疗器械公司上市的规定
1、18A章对于生物科技公司申请上市的要求
根据18A章申请上市的申请人必须:
(i) 向联交所证明并令其确信申请人合资格及适合以生物科技公司的身份上市;
(i) 上市时的市值至少达15亿港元;
(ii) 上市前已由大致相同的管理层经营现有的业务至少两个会计年度;及
(iii) 确保申请人有充足的营运资金(包括计入新申请人首次上市的所得款项),足可应付集团由上市文件刊发日期起计至少十二个月所需开支的至少125%。该等开支应主要包括:
(a) 一般、行政及营运开支(包括任何生产成本);及
(b) 研发开支。
2、指引信对于生物科技公司申请上市的要求
医疗器械公司若能证明其具备以下特点,则即使不符合在联交所上市所须通过的《主板规则》第8.05(1)条的盈利测试、第8.05(2)条的市值╱收益╱现金流量测试或第8.05(3)条的市值╱收益测试(统称“财务资格测试”),亦可获准根据18A章上市:
(i) 生物科技公司必须至少有一项核心产品已通过概念阶段。联交所会根据核心产品是否已达到相关类别产品的发展进度目标,来厘定该产品是否已通过概念阶段;
(ii) 主要专注于研究及开发(以下简称“研发”)以开发核心产品;
(iii) 上市前最少十二个月一直从事核心产品的研发,而若核心产品是外购许可技术或购自第三方的核心产品,申请人须能展示外购许可技术/购得产品以来的研发进度;
(iv) 上市集资主要作研发用途,以将核心产品推出市场;
(v) 必须拥有与其核心产品有关的已注册专利、专利申请及╱或知识产权;
(vi) 如申请人从事医药(小分子药物)产品或生物产品研发,须证明其拥有多项潜在产品;及;
(vii) 在建议上市日期的至少六个月前已获至少一名资深投资者提供相当数额的第三方投资(不只是象征式投资),且至进行首次公开招股时仍未撤回投资。这项规定是要证明申请人的研发及生物科技产品有相当程度的市场认可。倘申请人是由母公司分拆出来,又能以其他方式向联交所证明并使其确信其研发和生物科技产品有相当程度的市场认可(例如:与其他发展成熟的研发公司合作),则联交所未必会要求申请人遵守这项规定。
就医疗器材(包括诊断器材)而言,在下列情况下联交所会视受规管产品视已通过概念阶段:
(i) 该产品是有关主管当局分类标准项下的第二级或以上分类医疗器材;
(ii) 该产品已至少通过一次人体临床试验,该试验将构成主管当局或认可机构[2]所需申请的关键部分;及
(iii) 主管当局或认可机构同意或并无反对申请人开展进一步临床试验;或主管当局(如属欧盟委员会成员,则认可机构)不反对申请人开始销售有关器材。
三、中国法律对于医疗器械行业的监管
在中国,医疗器械行业属于一个“强监管”的领域,一个医疗器械从“出生”到“上市”均受到国家监管部门的“重点照顾”。
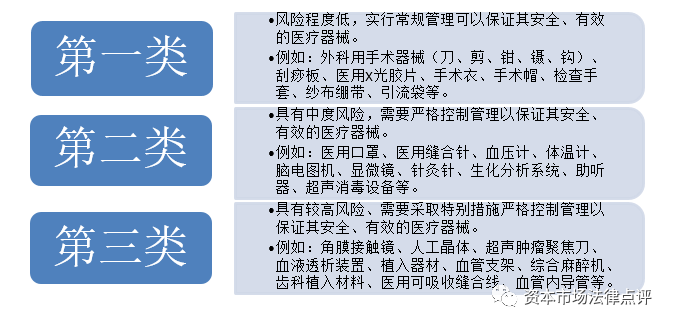
1、医疗器械的分类
2、医疗器械的监管法律

3、临床前研究
临床试验前,申办者[4]应当完成试验用医疗器械的临床前研究,包括产品设计(结构组成、工作原理和作用机理、预期用途以及适用范围、适用的技术要求)和质量检验、动物试验以及风险分析等,且结果应当能够支持该项临床试验。质量检验结果包括自检报告和具有资质的检验机构出具的一年内的产品注册检验合格报告。
在进行临床试验之前,通常会进行动物试验,由于进行动物试验需要取得相关的资质证照,例如实验动物使用许可证、国家重点保护野生动物驯养繁殖许可证,而医疗器械企业不一定持有上述证照,因此医疗器械企业可能会委托合同研究组织(“CRO”,即Contract Research Organization)来辅助进行动物试验。此外,如果医疗器械的临床前研究涉及病原微生物的,则需要在专门的病原微生物实验室进行试验,在此等情形下,没有配置病原微生物实验室的医疗器械企业也会引入具有前述资质的合同研究组织帮助其进行临床前研究。
4、临床试验
(1)第一类医疗器械产品备案,不需要进行临床试验。申请第二类、第三类医疗器械产品注册,应当进行临床试验;但是,有下列情形之一的,可以免于进行临床试验:(一)工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;(二)通过非临床评价能够证明该医疗器械安全、有效的;(三)通过对同品种医疗器械临床试验或者临床使用获得的数据进行分析评价,能够证明该医疗器械安全、有效的。
(2)医疗器械临床试验应当在两个或者两个以上医疗器械临床试验机构中进行。
(3)临床试验应当获得医疗器械临床试验机构伦理委员会的同意。列入需进行临床试验审批的第三类医疗器械目录的,还应当获得国家食品药品监督管理总局的批准。
(4)临床试验前,申办者应当向所在地省、自治区、直辖市食品药品监督管理部门备案。
需要注意的是,对于列入需进行临床试验审批的第三类医疗器械目录的第三类医疗器,就其临床试验,即使其取得了国家食品药品监督管理总局的批准,仍然需要向省级食品药品监督管理部门办理备案。
在临床试验阶段,合同研究组织也可以广泛的参与,例如试验设计及临床研究方案的撰写;提供符合GCP的临床研究中心及主要研究者;临床数据管理与统计分析;试验监查及数据管理;试验报告撰写,中心实验室、语音互动系统、药物安全监测、项目管理、质量管理和控制等。
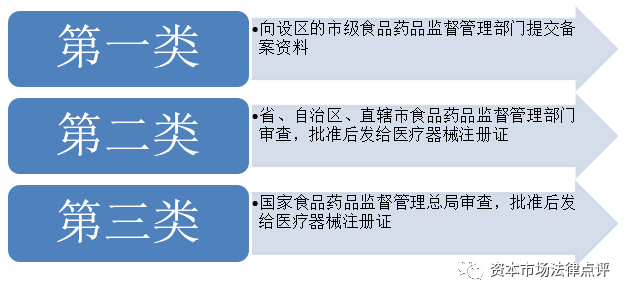
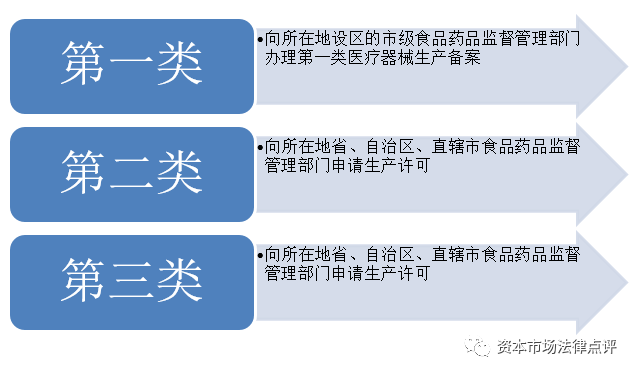
5、医疗器械注册
6、医疗器械生产企业
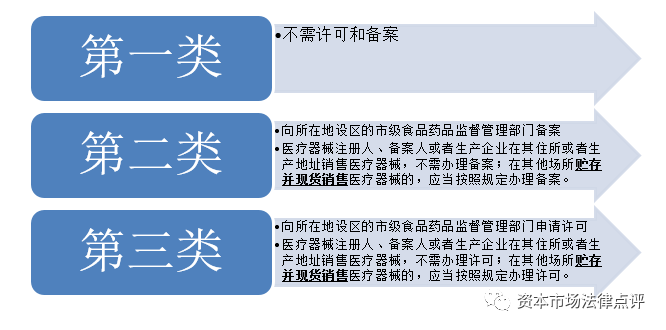
7、医疗器械经营企业
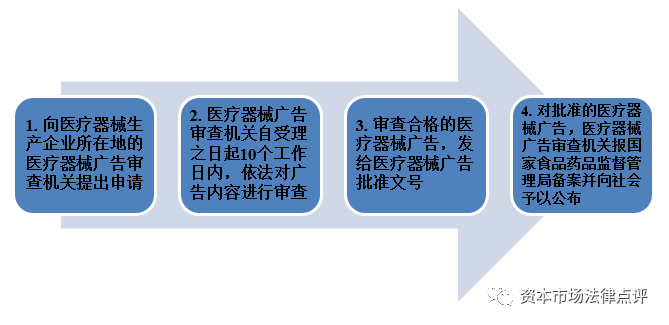
8、医疗器械广告
根据现行有效的《医疗器械广告审查办法》,在发布医疗器械广告之前,需要获得医疗器械广告批准文号,具体流程如下:
9、创新医疗器械
根据《国家药品监督管理局关于发布创新医疗器械特别审查程序的公告》,如被认定为“创新医疗器械”,将有“绿色通道”可以走,包括医疗器械检验机构在进行检验时,应当优先进行检验,并出具检验报告;器审中心对已受理注册申报的创新医疗器械,应当优先进行技术审评;技术审评结束后,国家药品监督管理局优先进行行政审批。
创新性医疗器械需要满足以下要求:
(一)申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权,创新医疗器械特别审查申请时间距专利授权公告日不超过5年;或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,报告载明产品核心技术方案具备新颖性和创造性。
(二)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
(三)产品主要工作原理或者作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,且具有显著的临床应用价值。
四、中国医疗器械企业在上市的过程中常见的问题
除了常见的社保和公积金的风险外,启明医疗以及康德莱医械并未披露存在与医疗器械行业相关的法律风险,根据过往项目的经验,在对于医疗器械企业进行合规性审核的时候需要关注以下几个方面:
1、资质证照
由于医疗器械行业属于“强监管”行业,因此,通常来看,医疗企业行业很少会像其他领域的公司一样缺乏相关的资质证照,在资质证照上成为“重灾区”。尽管如此,我们还是要对于医疗器械企业在资质证照方面的合规性进行仔细的核查。
对于医疗器械生产企业而言,需要取得医疗器械注册证、医疗器械生产许可证(如生产第二类或者第三类医疗器械)、医疗器械生产备案凭证(如生产第一类器械)等;对于医疗器械经营企业而言,需要取得医疗器械经营备案凭证(如经营第二类医疗器械)、医疗器械经营许可证(如经营第三类医疗器械)等;如医疗器械企业自身做临床试验,并且该等临床试验涉及动物、病原微生物或者辐射的,则其自身需要取得《实验动物使用许可证》、《国家重点保护野生动物驯养繁殖许可证》、病原微生物实验室备案或者《辐射安全许可证》。
除了医疗器械生产企业或者医疗器械经营企业自身资质证照的合规性审查外,由于医疗器械行业的特殊性,同样需要对于与其合作的一些企业是否具备相应的资质证照进行核查。例如,为医疗器械企业处理废弃物的,需要持有《危险废物经营许可证》;为医疗器械企业提供灭菌服务的,需要有灭菌的资质;租用第三方厂房的,环保验收和消防验收是否在搬入厂房之前均已经完成,并且如果医疗器械生产企业改变厂房原有用途的,还需要重新办理环保验收和消防验收。
2、对于“该产品已至少通过一次人体临床试验,该试验将构成主管当局或认可机构所需申请的关键部分”的理解
根据指引信的要求,申请上市的医疗器械企业的产品已至少通过一次人体临床试验,该试验将构成主管当局或认可机构所需申请的关键部分。前述要求可以拆分为两点:(1)产品已经完成一个完整的人体临床试验,而不是一次临床试验的一个阶段;(2)该次完整的人体临床试验必须构成主管当局或认可机构所需申请的“关键部分”。因此,如果有的医疗器械企业的产品只是完成了一次临床试验的一个阶段,或者虽然完成了该次完整的临床试验,但是无法构成申请《医疗器械注册证》的“关键部分”,则无法根据18A章申请上市。在实操层面,需要各个中介机构去解释拟上市主体如何满足指引信的上述要求。
3、医疗器械的销售合同是否构成纵向垄断
根据《反垄断法》第十四条的规定,禁止经营者与交易相对人达成下列垄断协议:(一)固定向第三人转售商品的价格;(二)限定向第三人转售商品的最低价格;(三)国务院反垄断执法机构认定的其他垄断协议。根据《反垄断法》第十五条的规定,经营者能够证明所达成的协议属于下列情形之一的,不适用本法第十三条、第十四条的规定:(一)为改进技术、研究开发新产品的;(二)为提高产品质量、降低成本、增进效率,统一产品规格、标准或者实行专业化分工的;(三)为提高中小经营者经营效率,增强中小经营者竞争力的;(四)为实现节约能源、保护环境、救灾救助等社会公共利益的;(五)因经济不景气,为缓解销售量严重下降或者生产明显过剩的;(六)为保障对外贸易和对外经济合作中的正当利益的;(七)法律和国务院规定的其他情形。属于前款第一项至第五项情形,不适用本法第十三条、第十四条规定的,经营者还应当证明所达成的协议不会严重限制相关市场的竞争,并且能够使消费者分享由此产生的利益。
实操层面,部分医疗器械生产企业会在与经销商的销售协议中锁定经销商向第三方转售的价格,而此等条款根据《反垄断法》第十四条的规定,是有可能被认定为构成纵向垄断。当然,在企业的初期,由于盘子不大,国家发改委可能不会来找企业的麻烦,但是待企业茁壮成长之后可能就说不准了。为了防止潜在的法律风险,建议修改与经销商的合同,比较稳妥的方法是在协议中约定经销商向第三方转售的价格区间,而非直接锁定转售的价格。
4、医疗器械企业在其官网上发布对于其产品的介绍是否构成互联网广告
根据现行有效的《医疗器械广告审查办法》,在发布医疗器械广告之前,需要获得医疗器械广告批准文号。如果医疗器械企业在电视或者通过广告经营者投放商业广告,很好理解,当然构成医疗器械广告,需要获得医疗器械广告批准文号。但是,如果医疗器械企业只是在其官网上发布对于产品的介绍,在此等情形下,该等介绍是否构成医疗器械广告呢?
根据《互联网广告管理暂行办法》第三条的规定,本办法所称互联网广告,是指通过网站、网页、互联网应用程序等互联网媒介,以文字、图片、音频、视频或者其他形式,直接或者间接地推销商品或者服务的商业广告。前款所称互联网广告包括:(一)推销商品或者服务的含有链接的文字、图片或者视频等形式的广告;(二)推销商品或者服务的电子邮件广告;(三)推销商品或者服务的付费搜索广告;(四)推销商品或者服务的商业性展示中的广告,法律、法规和规章规定经营者应当向消费者提供的信息的展示依照其规定;(五)其他通过互联网媒介推销商品或者服务的商业广告。
从上述内容可以看出,通过互联网媒介推销商品或者服务的商业广告行为是互联网广告,为保护消费者知情权而提供商品或服务的基本信息的行为,不是互联网广告行为。但是,在法规层面,为保护消费者知情权而提供的商品或服务的基本信息与广告的界限比较的模糊,例如《消费者权益保护法》第八条规定,消费者有权根据商品或者服务的不同情况,要求经营者提供商品的价格、产地、生产者、用途、性能、规格、等级、主要成份、生产日期、有效期限、检验合格证明、使用方法说明书、售后服务,或者服务的内容、规格、费用等有关情况。但是《广告法》第二十条又规定,广告有下列情形之一的,为虚假广告:(一)商品或者服务不存在的;(二)商品的性能、功能、产地、用途、质量、规格、成分、价格、生产者、有效期限、销售状况、曾获荣誉等信息,或者服务的内容、提供者、形式、质量、价格、销售状况、曾获荣誉等信息,以及与商品或者服务有关的允诺等信息与实际情况不符,对购买行为有实质性影响的;(三)使用虚构、伪造或者无法验证的科研成果、统计资料、调查结果、文摘、引用语等信息作证明材料的;(四)虚构使用商品或者接受服务的效果的;(五)以虚假或者引人误解的内容欺骗、误导消费者的其他情形。商品的性能、功能、产地、用途、质量、规格、成分、价格、生产者按照《广告法》,是广告的内容,但是《消费者权益保护法》又把其作为消费者应当有权知道的基本信息,不属于广告。在对于医疗器械行业监管趋严的形势下,比较稳妥的做法还是就医疗器械企业在官网发布的产品介绍取得医疗器械广告批准文号。
本次疫情来势汹汹,疫情充分说明了医疗器械的重要性,相信在不久的将来,医械行业的发展规模会越来越大。相信更多的医疗器械企业会在资本市场上崭露头角。
[1]联交所于2019年10月对于指引信做了修订。
[2]主管当局或欧盟委员会认可、承认或注册的机构、团体或委员会,可进行、评估及监管相关临床领域的临床试验。联交所可按情况酌情承认其他机构、团体或委员会为认可机构。
[3]《医疗器械广告审查办法》将于2020年3月1日失效,被《药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法》所取代。
[4]申办者指发起试验的公司、机构或组织。

合伙人
139 1840 6050
Wechat JT_Jerry

合伙人
137 6423 7102
Wechat sawnjiang
生物科技公司在香港上市盘点:2019年上市 16 家、募资 388 亿港元
生物科技公司及投资者的常见问题及答案 – 《香港交易所与生物科技》第二期
沛嘉医疗,来自江苏苏州、神经和心血管手术的高端医疗器械研发商,递交招股书、拟香港主板IPO上市
康德莱医疗器械 (01501.HK),11月8日在香港成功挂牌上市,募资 8.32 亿港元
启明医疗-B(02500.HK),12月10日在香港成功挂牌上市,募资 25.92 亿港元



