來源 | 資本市場法律點評
作者 | 葉玉盛、蔣濤 (競天公誠)
(圖片來源於91加盟網)
一、不負好時光——醫療器械公司在香港資本市場迎來「黃金時代」
香港聯合證券交易所有限公司(以下簡稱「聯交所」)於2018年4月修訂了主板上市規則,新增第18A章《生物科技公司》(以下簡稱「18A章」),允許未有收入、未有利潤的生物科技公司提交上市申請,同時聯交所亦於2018年4月發佈了有關生物科技公司上市申請的指引信(HKEX-GL92-18)(以下簡稱「指引信」)[1],對於生物科技公司依據18A章上市作出了進一步的闡釋。
生物科技公司在前期需要大量的資金用於研發、臨床試驗等,因此通常沒有相當的利潤符合上市的要求,上市之路比較的坎坷。而18A章以及指引信的發佈使得有「硬科技」但尚沒有盈利的生物科技公司的上市成為可能。從2019年香港資本市場來看,共有19家生物科技公司成功上市,具體如下:
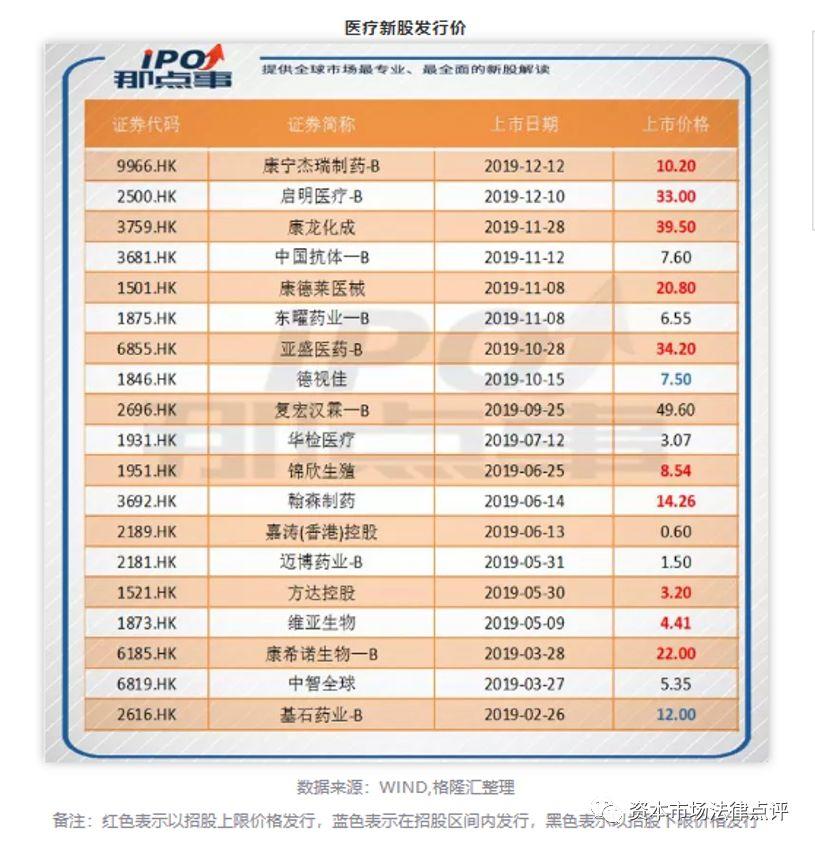
整體來看,這19家生物科技公司中依據18A章上市的共有9家,佔比為47.4%。此外,生物科技公司表現良好,其中10家公司以招股上限價格發行股票,2家公司在招股區間內發行股票,只有7家公司以招股下限價格發行股票。生物科技公司中的兩家醫療器械公司啟明醫療和康德萊醫械更是均以招股上限價格發行股票。
截至2020年2月21日收盤時止,上述19家生物科技公司的股價如下:
|
證券代碼 |
證券簡稱 |
股價(港元) |
|
9966.HK |
康寧傑瑞製藥-B |
19.420 |
|
2500.HK |
啟明醫療-B |
44.800 |
|
3759.HK |
康龍化成 |
56.100 |
|
3681.HK |
中國抗體-B |
3.750 |
|
1501.HK |
康德萊醫械 |
39.900 |
|
1875.HK |
東曜葯業-B |
3.790 |
|
6855.HK |
亞盛醫藥-B |
27.800 |
|
1846.HK |
德視佳 |
8.330 |
|
2696.HK |
復宏漢霖-B |
37.500 |
|
1931.HK |
華檢醫療 |
3.760 |
|
1951.HK |
錦欣生殖 |
10.460 |
|
3692.HK |
翰森製藥 |
26.350 |
|
2189.HK |
嘉濤(香港)控股 |
0.560 |
|
2181.HK |
邁博葯業-B |
1.000 |
|
1521.HK |
方達控股 |
5.100 |
|
1873.HK |
維亞生物 |
4.220 |
|
6185.HK |
康希諾生物-B |
81.150 |
|
6819.HK |
中智全球 |
5.800 |
|
2616.HK |
基石葯業-B |
10.660 |
生物科技公司上市後的股價表現也整體良好,除了8家公司目前的股價跌破發行價以外,其餘的生物醫藥科技公司目前的股價較發行價格均有不同程度的漲幅。截至2020年2月21日收盤時止,兩家醫療器械公司啟明醫療和康德萊醫械的股價更是分別上漲了35.8%、91.8%。
從以上數據來看,生物科技公司(包括醫療器械公司)在香港資本市場迎來了屬於自己的「黃金時代」,我們預測「生物科技」這個賽道在2020年將持續火熱。
二、18A章以及指引信對於醫療器械公司上市的規定
1、18A章對於生物科技公司申請上市的要求
根據18A章申請上市的申請人必須:
(i) 向聯交所證明並令其確信申請人合資格及適合以生物科技公司的身份上市;
(i) 上市時的市值至少達15億港元;
(ii) 上市前已由大致相同的管理層經營現有的業務至少兩個會計年度;及
(iii) 確保申請人有充足的營運資金(包括計入新申請人首次上市的所得款項),足可應付集團由上市文件刊發日期起計至少十二個月所需開支的至少125%。該等開支應主要包括:
(a) 一般、行政及營運開支(包括任何生產成本);及
(b) 研發開支。
2、指引信對於生物科技公司申請上市的要求
醫療器械公司若能證明其具備以下特點,則即使不符合在聯交所上市所須通過的《主板規則》第8.05(1)條的盈利測試、第8.05(2)條的市值╱收益╱現金流量測試或第8.05(3)條的市值╱收益測試(統稱「財務資格測試」),亦可獲准根據18A章上市:
(i) 生物科技公司必須至少有一項核心產品已通過概念階段。聯交所會根據核心產品是否已達到相關類別產品的發展進度目標,來釐定該產品是否已通過概念階段;
(ii) 主要專註於研究及開發(以下簡稱「研發」)以開發核心產品;
(iii) 上市前最少十二個月一直從事核心產品的研發,而若核心產品是外購許可技術或購自第三方的核心產品,申請人須能展示外購許可技術/購得產品以來的研發進度;
(iv) 上市集資主要作研發用途,以將核心產品推出市場;
(v) 必須擁有與其核心產品有關的已註冊專利、專利申請及╱或知識產權;
(vi) 如申請人從事醫藥(小分子藥物)產品或生物產品研發,須證明其擁有多項潛在產品;及;
(vii) 在建議上市日期的至少六個月前已獲至少一名資深投資者提供相當數額的第三方投資(不只是象徵式投資),且至進行首次公開招股時仍未撤回投資。這項規定是要證明申請人的研發及生物科技產品有相當程度的市場認可。倘申請人是由母公司分拆出來,又能以其他方式向聯交所證明並使其確信其研發和生物科技產品有相當程度的市場認可(例如:與其他發展成熟的研發公司合作),則聯交所未必會要求申請人遵守這項規定。
就醫療器材(包括診斷器材)而言,在下列情況下聯交所會視受規管產品視已通過概念階段:
(i) 該產品是有關主管當局分類標準項下的第二級或以上分類醫療器材;
(ii) 該產品已至少通過一次人體臨床試驗,該試驗將構成主管當局或認可機構[2]所需申請的關鍵部分;及
(iii) 主管當局或認可機構同意或並無反對申請人開展進一步臨床試驗;或主管當局(如屬歐盟委員會成員,則認可機構)不反對申請人開始銷售有關器材。
三、中國法律對於醫療器械行業的監管
在中國,醫療器械行業屬於一個「強監管」的領域,一個醫療器械從「出生」到「上市」均受到國家監管部門的「重點照顧」。
1、醫療器械的分類
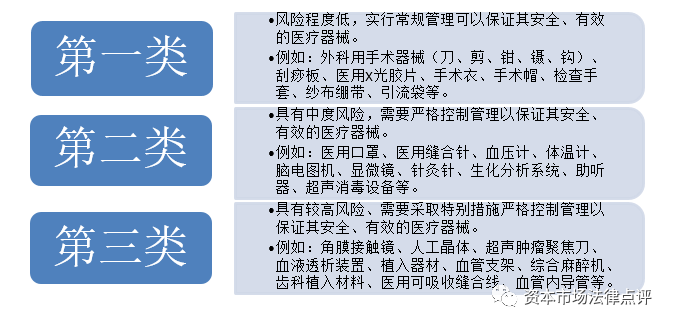
2、醫療器械的監管法律

3、臨床前研究
臨床試驗前,申辦者[4]應當完成試驗用醫療器械的臨床前研究,包括產品設計(結構組成、工作原理和作用機理、預期用途以及適用範圍、適用的技術要求)和質量檢驗、動物試驗以及風險分析等,且結果應當能夠支持該項臨床試驗。質量檢驗結果包括自檢報告和具有資質的檢驗機構出具的一年內的產品註冊檢驗合格報告。
在進行臨床試驗之前,通常會進行動物試驗,由於進行動物試驗需要取得相關的資質證照,例如實驗動物使用許可證、國家重點保護野生動物馴養繁殖許可證,而醫療器械企業不一定持有上述證照,因此醫療器械企業可能會委託合同研究組織(「CRO」,即Contract Research Organization)來輔助進行動物試驗。此外,如果醫療器械的臨床前研究涉及病原微生物的,則需要在專門的病原微生物實驗室進行試驗,在此等情形下,沒有配置病原微生物實驗室的醫療器械企業也會引入具有前述資質的合同研究組織幫助其進行臨床前研究。
4、臨床試驗
(1)第一類醫療器械產品備案,不需要進行臨床試驗。申請第二類、第三類醫療器械產品註冊,應當進行臨床試驗;但是,有下列情形之一的,可以免於進行臨床試驗:(一)工作機理明確、設計定型,生產工藝成熟,已上市的同品種醫療器械臨床應用多年且無嚴重不良事件記錄,不改變常規用途的;(二)通過非臨床評價能夠證明該醫療器械安全、有效的;(三)通過對同品種醫療器械臨床試驗或者臨床使用獲得的數據進行分析評價,能夠證明該醫療器械安全、有效的。
(2)醫療器械臨床試驗應當在兩個或者兩個以上醫療器械臨床試驗機構中進行。
(3)臨床試驗應當獲得醫療器械臨床試驗機構倫理委員會的同意。列入需進行臨床試驗審批的第三類醫療器械目錄的,還應當獲得國家食品藥品監督管理總局的批准。
(4)臨床試驗前,申辦者應當向所在地省、自治區、直轄市食品藥品監督管理部門備案。
需要注意的是,對於列入需進行臨床試驗審批的第三類醫療器械目錄的第三類醫療器,就其臨床試驗,即使其取得了國家食品藥品監督管理總局的批准,仍然需要向省級食品藥品監督管理部門辦理備案。
在臨床試驗階段,合同研究組織也可以廣泛的參與,例如試驗設計及臨床研究方案的撰寫;提供符合GCP的臨床研究中心及主要研究者;臨床數據管理與統計分析;試驗監查及數據管理;試驗報告撰寫,中心實驗室、語音互動系統、藥物安全監測、項目管理、質量管理和控制等。
5、醫療器械註冊
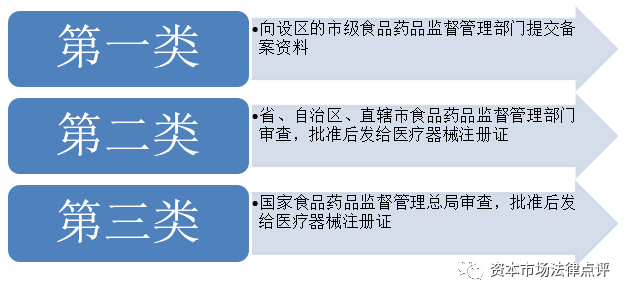
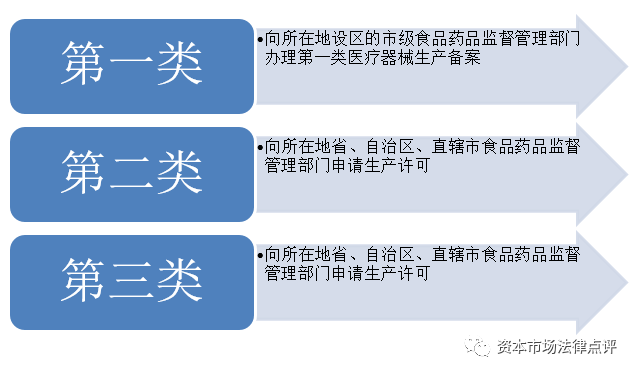
6、醫療器械生產企業
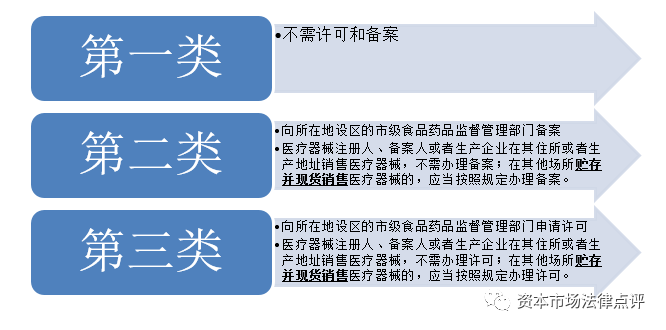
7、醫療器械經營企業
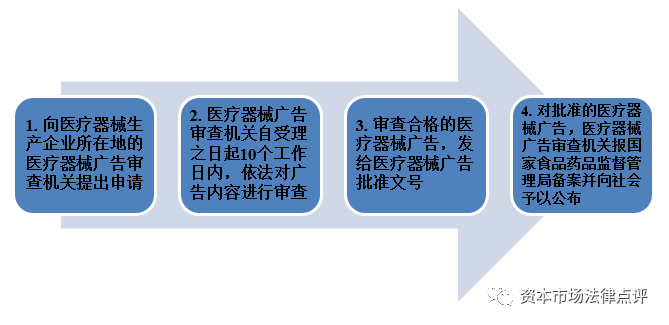
8、醫療器械廣告
根據現行有效的《醫療器械廣告審查辦法》,在發佈醫療器械廣告之前,需要獲得醫療器械廣告批准文號,具體流程如下:
9、創新醫療器械
根據《國家藥品監督管理局關於發佈創新醫療器械特別審查程序的公告》,如被認定為「創新醫療器械」,將有「綠色通道」可以走,包括醫療器械檢驗機構在進行檢驗時,應當優先進行檢驗,並出具檢驗報告;器審中心對已受理註冊申報的創新醫療器械,應當優先進行技術審評;技術審評結束後,國家藥品監督管理局優先進行行政審批。
創新性醫療器械需要滿足以下要求:
(一)申請人通過其主導的技術創新活動,在中國依法擁有產品核心技術發明專利權,或者依法通過受讓取得在中國發明專利權或其使用權,創新醫療器械特別審查申請時間距專利授權公告日不超過5年;或者核心技術發明專利的申請已由國務院專利行政部門公開,並由國家知識產權局專利檢索諮詢中心出具檢索報告,報告載明產品核心技術方案具備新穎性和創造性。
(二)申請人已完成產品的前期研究並具有基本定型產品,研究過程真實和受控,研究數據完整和可溯源。
(三)產品主要工作原理或者作用機理為國內首創,產品性能或者安全性與同類產品比較有根本性改進,技術上處於國際領先水平,且具有顯著的臨床應用價值。
四、中國醫療器械企業在上市的過程中常見的問題
除了常見的社保和公積金的風險外,啟明醫療以及康德萊醫械並未披露存在與醫療器械行業相關的法律風險,根據過往項目的經驗,在對於醫療器械企業進行合規性審核的時候需要關注以下幾個方面:
1、資質證照
由於醫療器械行業屬於「強監管」行業,因此,通常來看,醫療企業行業很少會像其他領域的公司一樣缺乏相關的資質證照,在資質證照上成為「重災區」。儘管如此,我們還是要對於醫療器械企業在資質證照方面的合規性進行仔細的核查。
對於醫療器械生產企業而言,需要取得醫療器械註冊證、醫療器械生產許可證(如生產第二類或者第三類醫療器械)、醫療器械生產備案憑證(如生產第一類器械)等;對於醫療器械經營企業而言,需要取得醫療器械經營備案憑證(如經營第二類醫療器械)、醫療器械經營許可證(如經營第三類醫療器械)等;如醫療器械企業自身做臨床試驗,並且該等臨床試驗涉及動物、病原微生物或者輻射的,則其自身需要取得《實驗動物使用許可證》、《國家重點保護野生動物馴養繁殖許可證》、病原微生物實驗室備案或者《輻射安全許可證》。
除了醫療器械生產企業或者醫療器械經營企業自身資質證照的合規性審查外,由於醫療器械行業的特殊性,同樣需要對於與其合作的一些企業是否具備相應的資質證照進行核查。例如,為醫療器械企業處理廢棄物的,需要持有《危險廢物經營許可證》;為醫療器械企業提供滅菌服務的,需要有滅菌的資質;租用第三方廠房的,環保驗收和消防驗收是否在搬入廠房之前均已經完成,並且如果醫療器械生產企業改變廠房原有用途的,還需要重新辦理環保驗收和消防驗收。
2、對於「該產品已至少通過一次人體臨床試驗,該試驗將構成主管當局或認可機構所需申請的關鍵部分」的理解
根據指引信的要求,申請上市的醫療器械企業的產品已至少通過一次人體臨床試驗,該試驗將構成主管當局或認可機構所需申請的關鍵部分。前述要求可以拆分為兩點:(1)產品已經完成一個完整的人體臨床試驗,而不是一次臨床試驗的一個階段;(2)該次完整的人體臨床試驗必須構成主管當局或認可機構所需申請的「關鍵部分」。因此,如果有的醫療器械企業的產品只是完成了一次臨床試驗的一個階段,或者雖然完成了該次完整的臨床試驗,但是無法構成申請《醫療器械註冊證》的「關鍵部分」,則無法根據18A章申請上市。在實操層面,需要各個中介機構去解釋擬上市主體如何滿足指引信的上述要求。
3、醫療器械的銷售合同是否構成縱向壟斷
根據《反壟斷法》第十四條的規定,禁止經營者與交易相對人達成下列壟斷協議:(一)固定向第三人轉售商品的價格;(二)限定向第三人轉售商品的最低價格;(三)國務院反壟斷執法機構認定的其他壟斷協議。根據《反壟斷法》第十五條的規定,經營者能夠證明所達成的協議屬於下列情形之一的,不適用本法第十三條、第十四條的規定:(一)為改進技術、研究開發新產品的;(二)為提高產品質量、降低成本、增進效率,統一產品規格、標準或者實行專業化分工的;(三)為提高中小經營者經營效率,增強中小經營者競爭力的;(四)為實現節約能源、保護環境、救災救助等社會公共利益的;(五)因經濟不景氣,為緩解銷售量嚴重下降或者生產明顯過剩的;(六)為保障對外貿易和對外經濟合作中的正當利益的;(七)法律和國務院規定的其他情形。屬於前款第一項至第五項情形,不適用本法第十三條、第十四條規定的,經營者還應當證明所達成的協議不會嚴重限制相關市場的競爭,並且能夠使消費者分享由此產生的利益。
實操層面,部分醫療器械生產企業會在與經銷商的銷售協議中鎖定經銷商向第三方轉售的價格,而此等條款根據《反壟斷法》第十四條的規定,是有可能被認定為構成縱向壟斷。當然,在企業的初期,由於盤子不大,國家發改委可能不會來找企業的麻煩,但是待企業茁壯成長之後可能就說不準了。為了防止潛在的法律風險,建議修改與經銷商的合同,比較穩妥的方法是在協議中約定經銷商向第三方轉售的價格區間,而非直接鎖定轉售的價格。
4、醫療器械企業在其官網上發佈對於其產品的介紹是否構成互聯網廣告
根據現行有效的《醫療器械廣告審查辦法》,在發佈醫療器械廣告之前,需要獲得醫療器械廣告批准文號。如果醫療器械企業在電視或者通過廣告經營者投放商業廣告,很好理解,當然構成醫療器械廣告,需要獲得醫療器械廣告批准文號。但是,如果醫療器械企業只是在其官網上發佈對於產品的介紹,在此等情形下,該等介紹是否構成醫療器械廣告呢?
根據《互聯網廣告管理暫行辦法》第三條的規定,本辦法所稱互聯網廣告,是指通過網站、網頁、互聯網應用程序等互聯網媒介,以文字、圖片、音頻、視頻或者其他形式,直接或者間接地推銷商品或者服務的商業廣告。前款所稱互聯網廣告包括:(一)推銷商品或者服務的含有鏈接的文字、圖片或者視頻等形式的廣告;(二)推銷商品或者服務的電子郵件廣告;(三)推銷商品或者服務的付費搜索廣告;(四)推銷商品或者服務的商業性展示中的廣告,法律、法規和規章規定經營者應當向消費者提供的信息的展示依照其規定;(五)其他通過互聯網媒介推銷商品或者服務的商業廣告。
從上述內容可以看出,通過互聯網媒介推銷商品或者服務的商業廣告行為是互聯網廣告,為保護消費者知情權而提供商品或服務的基本信息的行為,不是互聯網廣告行為。但是,在法規層面,為保護消費者知情權而提供的商品或服務的基本信息與廣告的界限比較的模糊,例如《消費者權益保護法》第八條規定,消費者有權根據商品或者服務的不同情況,要求經營者提供商品的價格、產地、生產者、用途、性能、規格、等級、主要成份、生產日期、有效期限、檢驗合格證明、使用方法說明書、售後服務,或者服務的內容、規格、費用等有關情況。但是《廣告法》第二十條又規定,廣告有下列情形之一的,為虛假廣告:(一)商品或者服務不存在的;(二)商品的性能、功能、產地、用途、質量、規格、成分、價格、生產者、有效期限、銷售狀況、曾獲榮譽等信息,或者服務的內容、提供者、形式、質量、價格、銷售狀況、曾獲榮譽等信息,以及與商品或者服務有關的允諾等信息與實際情況不符,對購買行為有實質性影響的;(三)使用虛構、偽造或者無法驗證的科研成果、統計資料、調查結果、文摘、引用語等信息作證明材料的;(四)虛構使用商品或者接受服務的效果的;(五)以虛假或者引人誤解的內容欺騙、誤導消費者的其他情形。商品的性能、功能、產地、用途、質量、規格、成分、價格、生產者按照《廣告法》,是廣告的內容,但是《消費者權益保護法》又把其作為消費者應當有權知道的基本信息,不屬於廣告。在對於醫療器械行業監管趨嚴的形勢下,比較穩妥的做法還是就醫療器械企業在官網發佈的產品介紹取得醫療器械廣告批准文號。
本次疫情來勢洶洶,疫情充分說明了醫療器械的重要性,相信在不久的將來,醫械行業的發展規模會越來越大。相信更多的醫療器械企業會在資本市場上嶄露頭角。
[1]聯交所於2019年10月對於指引信做了修訂。
[2]主管當局或歐盟委員會認可、承認或註冊的機構、團體或委員會,可進行、評估及監管相關臨床領域的臨床試驗。聯交所可按情況酌情承認其他機構、團體或委員會為認可機構。
[3]《醫療器械廣告審查辦法》將於2020年3月1日失效,被《藥品、醫療器械、保健食品、特殊醫學用途配方食品廣告審查管理暫行辦法》所取代。
[4]申辦者指發起試驗的公司、機構或組織。

合伙人
139 1840 6050
Wechat JT_Jerry

合伙人
137 6423 7102
Wechat sawnjiang
生物科技公司在香港上市盤點:2019年上市 16 家、募資 388 億港元
生物科技公司及投資者的常見問題及答案 – 《香港交易所與生物科技》第二期
沛嘉醫療,來自江蘇蘇州、神經和心血管手術的高端醫療器械研發商,遞交招股書、擬香港主板IPO上市
康德萊醫療器械 (01501.HK),11月8日在香港成功掛牌上市,募資 8.32 億港元
啟明醫療-B(02500.HK),12月10日在香港成功掛牌上市,募資 25.92 億港元



