復必泰,是復星醫藥、biontech、輝瑞三家聯合研發、數據共享

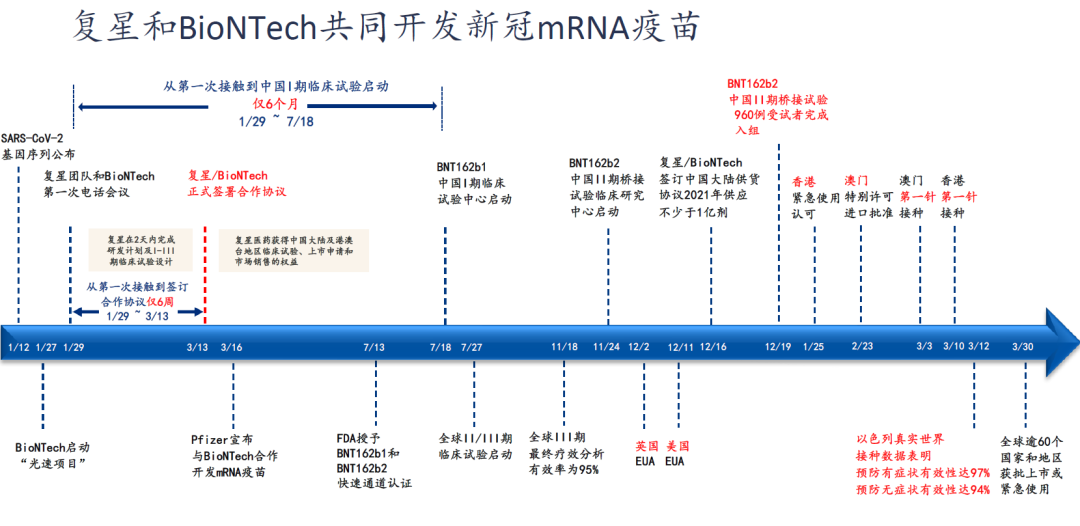
2020年3月13日,復星醫藥產業與BioNTech簽訂協議,前者由此獲得了在中國獨家開發、商業化基於後者專有的mRNA技術平台研發的mRNA新冠疫苗的許可;
2020年11月16日,復星醫藥產業mRNA新冠疫苗BNT162b2的臨床試驗獲得中國藥品監督管理局批准;
截至2020年12月19日,新冠疫苗BNT162b2在中國的II期臨床試驗已提前完成960位受試者入組;
2021年1月25日,「復必泰」獲得香港緊急使用認可;
2021年2月23日,「復必泰」獲得澳門特別許可進口批准;
2021年3月3日,澳門第一針接種;
2021年3月10日,香港第一針接種;
…
版權聲明:所有瑞恩資本Ryanben Capital的原創文章,轉載須聯繫授權,並在文首/文末註明來源、作者、微信ID,否則瑞恩將向其追究法律責任。部分文章推送時未能與原作者或公眾號平台取得聯繫。若涉及版權問題,敬請原作者聯繫我們。
復星BioNTech疫苗接種注意什麼?復星詳解「復必泰」副作用、接種注意事項
復星醫藥子公司Gland Pharma在印度IPO上市,第一家中資控股的印度上市公司
香港IPO市場(前四個月):上市35家、退市21家,募資1,551億、增7.5倍
香港 IPO中介機構排行榜 (過去24個月:2019年5月-2021年4月)



