
8月22日,總部位於江蘇泰州中國醫藥城的邁博葯業向香港聯交所遞交上市申請,擬在香港主板紅籌上市,中金國際為獨家保薦人。
邁博葯業是中國領先的生物醫藥公司, 專註於癌症和自身免疫性疾病單克隆抗體藥物的研究和生產。邁博葯業,致力於透過高校的研發體系以及低成本藥品生產能力為市場帶來高質量的可負擔的創新型生物藥品,並充分利用自身豐富的研發經驗開發不同的治療產品。
邁博葯業的候選藥物管線目前包括9個單抗藥物,其中3個為處於臨床三期的核心產品:CMAB007(奧馬珠單抗)、CMAB009(西妥昔單抗)、CMAB008(英夫利昔單抗)。截至最後可實行之日,CMAB007(奧馬珠單抗)為中國本土公司在中國開發的唯一一種已達到III期臨床試驗的單抗哮喘療法,一旦獲得國家食品葯監總局批准,將是由中國本土公司開發並在中國上市的第一生物靶向治療哮喘的藥物。
就邁博葯業的招股書,Ryanben Capital從業務、財務、法律等方面進行分析。

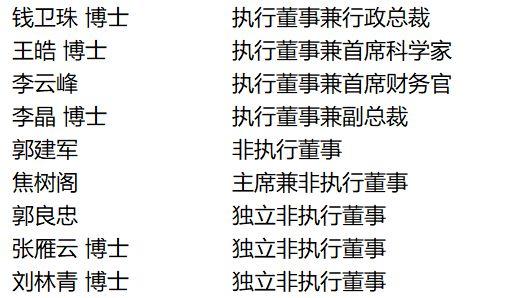
邁博葯業董事會成員:
邁博葯業主要管理團隊:

1. 經營業績概要
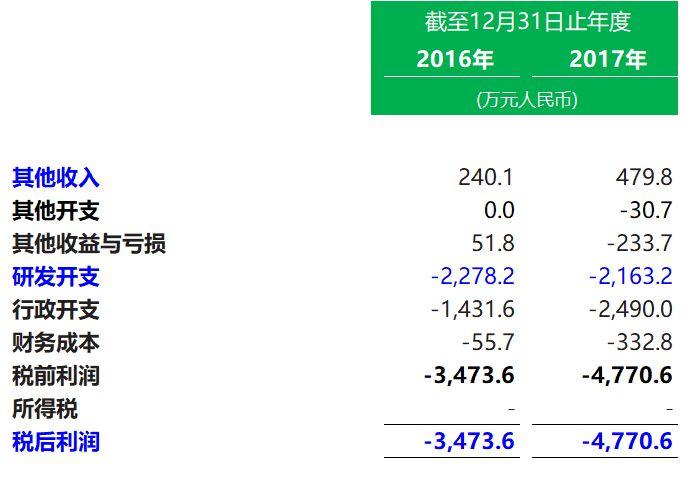
其中收入明細:
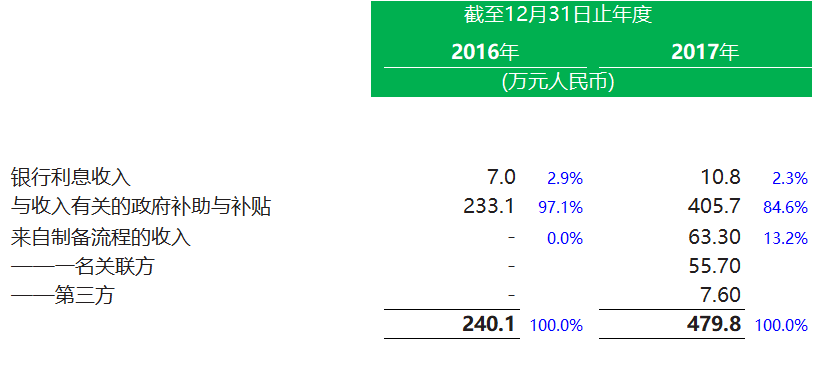
其中研發開支:

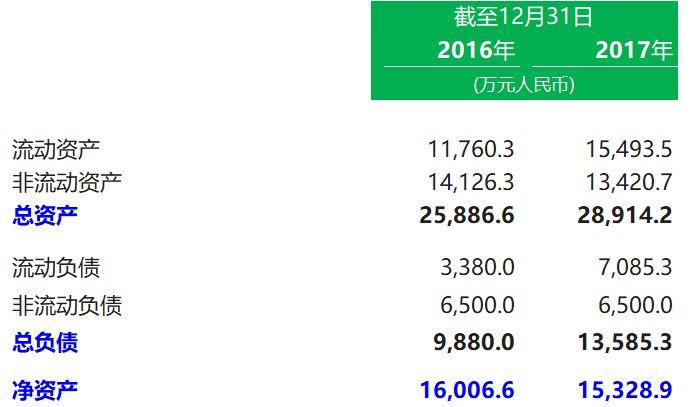
2. 資產負債表概要
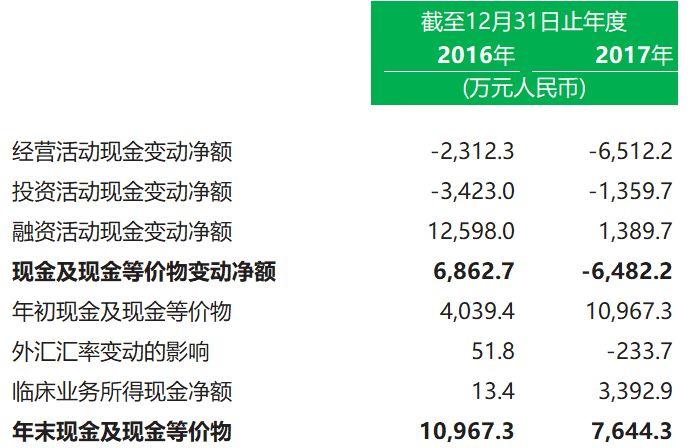
3. 現金流量表概要
4. 主要財務指標數據

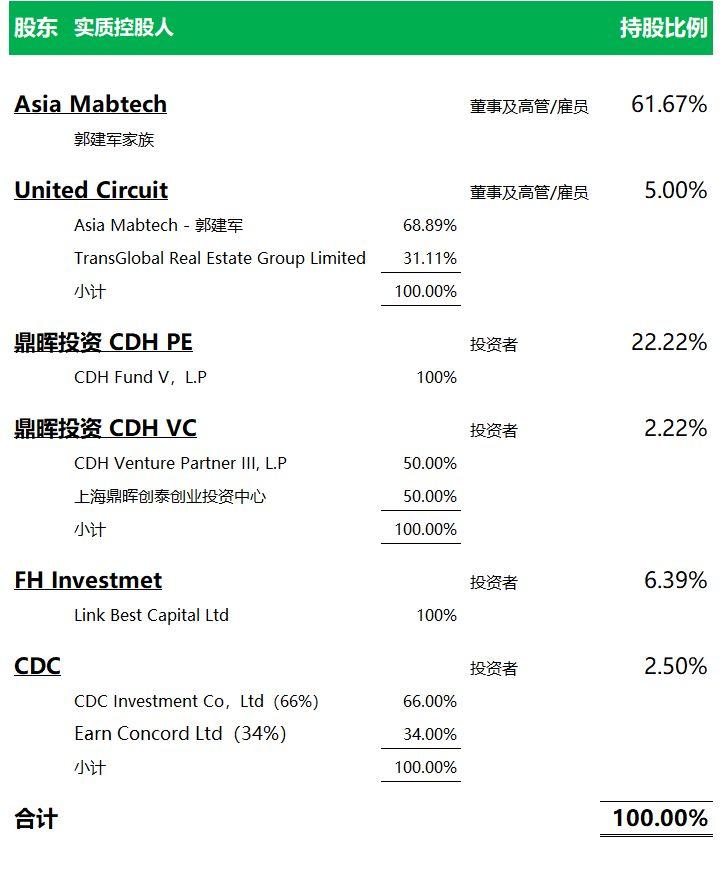
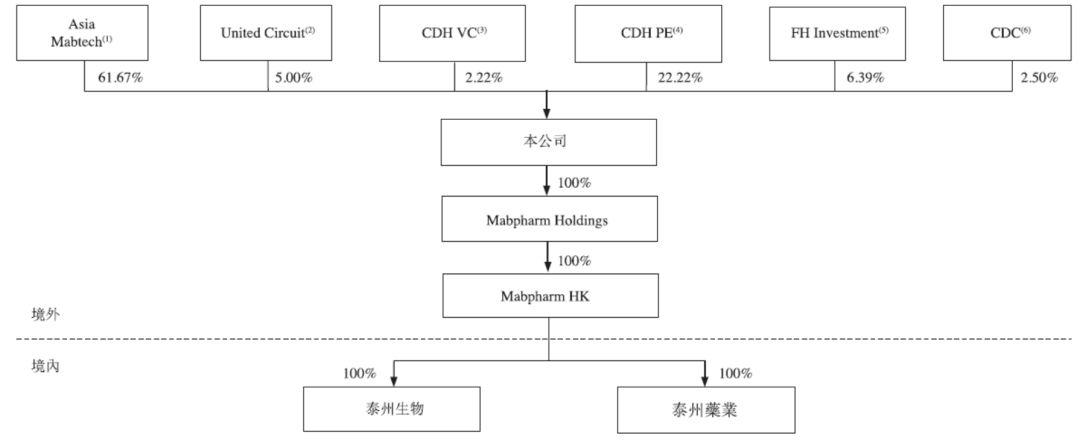
邁博葯業自成立以來,融資金額累計達1.512億美元,截至上市前,康希諾生物股東結構如下:
2015年2月,註冊成立泰州葯業;
2015年12月,獲得CDH PE 投資;
2015年12月,Sinomab 集團取得CMAB007、CMAB009及CMAB008 的所有權利及權益;
2016年5月,泰州葯業的「3*1500 升抗體生物反應器系統」投入營運;
2016年11月,註冊成立泰州生物;
2017年1月,CMAB009 的臨床用藥製備完成;
2017年4月,注射用重組抗HER2 人源單克隆抗體(「CMAB809」)獲得臨床批件;
2017年7月,CMAB007 的臨床用藥製備完成;
2017年9月,CMAB008 的臨床用藥製備完成;
2017年9月,重組抗PD1 全人源單克隆抗體注射液(「CMAB819」)獲得臨床批件;
2017年9月,開始CMAB008 及CMAB009 三期臨床試驗;
2017年10月,開始CMAB007 三期臨床試驗;
2018年8月,重組完成並遞交招股書。
本文由Ryanben Capital原創,轉載需經過授權,歡迎在文章底部留言。
版權聲明:所有瑞恩資本Ryanben Capital的原創文章,轉載須聯繫授權,並在文首/文末註明來源、作者、微信ID,否則瑞恩資本Ryanben Capital將向其追究法律責任。部分文章推送時未能與原作者或公眾號平台取得聯繫。若涉及版權問題,敬請原作者聯繫我們。
製藥企業.香港IPO : 來自江蘇連雲港的豪森葯業,9月6日遞交招股書,可能成為香港最大的醫藥IPO
生物科技.香港IPO : 來自江蘇蘇州的亞盛醫藥,8月20日遞交招股書
生物科技.香港IPO:康希諾生物 Cansino,7月17日遞交招股書
生物科技公司.香港IPO:信達生物 Innovent,6月28日遞交招股書
生物科技公司.香港IPO:盟科醫藥 MicuRx,6月28日遞交招股書
歌禮生物(Ascletis)遞交招股書,香港新上市制度的第一家生物科技公司


